肺癌
| 肺癌 Lung cancer |
|
|---|---|
 胸部X光片(胸片)显示出肺部肿瘤(箭头所指处)。
|
|
| 分类和外部资源 | |
| 疾病分类 | 肿瘤学 |
| ICD-10 | C33 -C34 |
| ICD-9-CM | 162 |
| OMIM | 211980 |
| DiseasesDB | 7616 |
| MedlinePlus | 007194 |
| eMedicine | med/1333 med/1336 emerg/335 radio/807 radio/405 radio/406 |
| PatientUK | lung-cancer-pro |
| MeSH | D002283 |
肺癌(英语:Lung cancer)是一种肺部的恶性肿瘤,特征为肺部组织中的细胞不受控制地生长。如果不进行治疗,那么肿瘤细胞会通过癌症转移的形式扩散至其他肺部组织或身体的其他部分。大多数始发于肺部的癌症,常称其为原发性肺癌,发生于上皮组织细胞。肺癌主要分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。肺癌最常见的临床症状有咳嗽(包括咳血),体重减轻,气短和胸痛[1]。
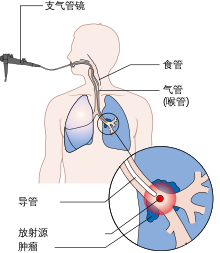
大多数(80-90%)肺癌患者患病的原因为长期吸入烟草烟雾[1][2],然而大约10-15%的患者从不吸烟[3],这部分人患上肺癌往往是由于遗传因素和吸入空气污染物共同导致[4],污染物包括氡气[4]、石棉[5]或其它形式的空气污染[4],包括二手烟[6][7]。肺癌在胸片或CT扫描中可见,并可通过支气管镜或CT引导下进行活检确诊[8]。
肺癌的治疗和长期疗效取决于取决于类型、阶段(转移的程度)和患者的整体健康状况。常见的治疗手段包括手术、化疗和放疗。非小细胞肺癌(NSCLC)有时采用手术治疗,而小细胞肺癌(SCLC)通常对化疗和放疗的反应明显。[9]总体而言,在美国确诊为肺癌的人中有16.8%存活时间超过5年[10],而这个比例在发展中国家则较低。世界上所有死于癌症的人中,占比最大的为肺癌,并且每年约有156万人死于肺癌,如2012年[11]。
症状和体征
可能暗示肺癌的症状包括:[1]
如果肿瘤生长在呼吸道,那么其可能会阻断气流,造成呼吸困难,还可能阻碍呼吸道分泌物的排出,使得分泌物聚积在呼吸道,增加患上肺炎的可能性(称为阻塞性肺炎)[1]。
不同类型肿瘤,会导致不同的副癌综合征(即与局部癌组织无关的临床症状),并且往往使人们最初意识到疾病的存在[12]。肺癌的副癌综合征可能包括:Lambert–Eaton肌无力综合征(自身抗体引起的肌无力)、高血钙症、抗利尿激素分泌异常综合征(SIADH,异常的尿液浓缩和血液稀释)。肺尖部的肿瘤称为潘科斯特瘤,可能会侵犯局部交感神经系统,导致霍纳氏综合征(眼睑低垂和同侧瞳孔缩小),也可能会损伤臂神经丛[1]。
肺癌的许多症状都是非特异性的,如食欲减退、消瘦、发热和疲乏无力[8]。因此许多患者在出现症状后就医时,癌组织早已从原发部位扩散转移[13]。提示出现癌转移的症状有消瘦、骨痛和神经系统症状(头痛、昏厥、惊厥或四肢无力)[1]。常见的转移部位有脑、骨、肾上腺、对侧肺、肝、心包膜和肾脏[13]。大约10%肺癌患者被确诊时没有临床症状,而是在常规胸片检查时意外发现[14]。
病因
癌症加速基因损伤转变为DNA和表观遗传的变化。这些变化会影响细胞的正常功能,包括细胞增殖、程序性细胞死亡(细胞凋亡)和DNA修复。损伤累积的越多,癌症发生的风险就越高[15]。
吸烟
吸烟,尤其是香烟(卷烟),是目前为止导致肺癌的主要原因[16]。香烟烟雾中含有至少73种已知的致癌物质[17],包括苯并芘[18]、亚硝胺、1,3-丁二烯和钋的放射性同位素钋-210[17]。在发展中国家2000年患肺癌死亡的男性中90%是吸烟所致(女性为70%)[19]。吸烟导致的肺癌患者占了肺癌病人的80–90%[1]。
被动吸烟(吸二手烟,意为吸入其他吸烟者产生的烟草烟雾)也是导致不吸烟的人患上肺癌的原因。美国[20][21][22]、欧洲[23]和英国[24]的研究都表明被动吸烟者患肺癌风险在显著增加[25]。和吸烟者共同生活的人患病风险增加20-30%,而工作环境中有二手烟的人其患病风险增加16-19%[26]。对侧流烟的调查研究表明其比直接吸烟更危险[27]。美国每年有大约3400人由于被动吸烟死于肺癌[22]。
大麻和烟草烟雾中含有许多相同致癌物[28],但是抽印度大麻对患肺癌风险的影响还不清楚[29]。[30]2013年的一项回顾调查并未发现轻度到中度吸食大麻会使患肺癌风险增加[31]。而2014年的回顾调查则发现吸食大麻会使患肺癌风险增加一倍[32]。
氡气
氡是一种无色无味的气体,由地壳中存在的铀的衰变产物镭分解后生成。这些放射衰变产物会使遗传物质电离,其因此导致的突变有时是致癌的。氡气是美国肺癌的第二大最常见病因[33],每年导致约21000人死亡[34]。氡气浓度每立方米升高100贝可(100 Bq/m³),其致癌风险就会增加8-16%[35]。氡气水平随区域和下层土壤、岩石的成分变化而不同。美国每15个家庭中就有大约一个的氡气水平超过了建议量每升4皮居里(4 pCi/l)[36]。
石棉
石棉可导致多种肺部疾病,包括肺癌。吸烟和吸入石棉对肺癌的形成有协同作用[5]。吸烟者工作环境中有石棉时,其患肺癌风险与普通人群相比增加了45倍[37]。石棉也可导致胸膜癌,称为间皮瘤(和肺癌不同)[38]。
空气污染
户外空气污染对患肺癌风险影响较小[4],汽车尾气中可能含有的细颗粒(PM2.5)和硫酸盐气溶胶可使风险轻度增加[4][39]。对二氧化氮而言浓度每递增亿分之一(10ppb),人患肺癌风险就上升14%[40]。据估算1-2%的肺癌由户外空气污染所致[4]。
初步证据支持室内空气污染会使患肺癌风险增加,包括做饭和取暖时燃烧木材、木炭、粪便或作物残茬[41]。暴露于室内煤烟的女性其患肺癌风险增加了大概一倍,许多生物质燃烧后的副产品是已知或可疑的致癌物[42]。这一风险影响到了全球大约24亿人[41],人们认为肺癌死亡中1.5%是由此导致的[42]。
遗传因素
约8%肺癌由遗传因素所致[43]。亲属中有肺癌患者时患病风险增加2.4倍,这可能是一组基因综合作用所致[44]。已知5,6和15号染色体上的基因多态性会影响患肺癌的风险[45]。
其他原因
许多其它物质、职业及所处环境都与肺癌有关联。国际癌症研究机构(IARC)声称有“充足证据证明”以下物质是肺部的致癌物:[46]
- 某些金属(铝制品、镉及其化合物、铬(VI)化合物、铍及其化合物、钢铁、镍化合物、砷及无机砷化合物、地下赤铁矿)
- 一些燃烧产物(不完全燃烧产物、煤(家庭烧煤所致室内排放物)、煤的气化物、煤-焦油沥青、焦炭生产所排放物质、煤烟、柴油机排放气体)
- 电离辐射(X射线、伽马射线、钚)
- 一些有害气体(甲醚(工业级)、双氯甲醚(氯甲基)、硫芥、MOPP(长春新碱-强的松-氮芥-甲基苄肼混合物)、油画释放的气体)
- 橡胶制品和结晶矽尘
发病机制
和许多其它癌症类似,肺癌也始于原癌基因的激活或抑癌基因的灭活[47]。致癌物导致能够诱发癌症发展的基因突变[48]。原癌基因的突变导致10-30%的肺腺癌[49][50]。大概4%的非小细胞肺癌与一个EML4-ALK酪氨酸激酶融合基因有关[51]。表观遗传学的变化——如DNA甲基化,组织蛋白尾部修饰或小核糖核酸(微RNA)调控的改变可能会导致抑癌基因的灭活[52]。
表皮细胞生长因子受体调控细胞增殖、凋亡、血管生成和肿瘤侵袭[49]。表皮细胞生长因子受体调控细胞增殖、凋亡、血管生成和肿瘤侵袭[49]。其它经常发生突变或扩增的基因有c-MET、NKX2-1、LKB1、PIK3CA和BRAF[49]。
其细胞系来源尚不完全清楚[1]。机理可能涉及干细胞的异常活化。在气道近端,表达角蛋白5的干细胞更易受累,通常导致肺鳞状细胞癌。在气道中部,受牵连的干细胞包括棒状细胞和表达棒状细胞分泌蛋白的神经上皮细胞。小细胞肺癌可能来源于这些细胞系[53]或神经分泌细胞[1],也可能会表达CD44[53]。
肺癌的转移需要细胞类型从上皮细胞转变为间质细胞。Akt/GSK3Beta、MEK-ERK、Fas和Par6等信号通路被激活后,这一转变可能会发生[54]。
COPD和肺纤维化(α1-抗胰蛋白酶缺乏)可能增加肺癌易感性;此外,吸烟者补充β-胡萝卜素也会增加患肺癌的危险性。空气污染和雪茄烟雾中含有致癌物质,这些致癌物质可能存在一定的致癌风险,但尚未显示可引起肺癌。患者若有其他的肺部疾病(如肺结核)所致瘢痕,那么他们的患癌风险也将增加。[2]
呼吸道上皮细胞需长时间暴露于促癌物质下并逐渐积累多种基因突变才能成为新生物。刺激细胞生长(K-ras, MYC)的基因突变逐渐导致生长因子受体(EGFR, HER2/neu)信号异常,抑制凋亡(BCL-2),引起异常细胞增殖。此外,肿瘤抑制基因的突变(p53,APC)亦可导致癌症。[2]
诊断
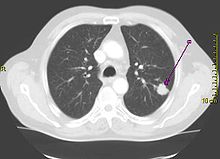
胸片是初筛检查。它可以显示明显的异常,如单个肿块、多发肿块、孤立的肺结节,肺门增大、纵隔增宽、气管支气管狭窄、肺不张、不消散的实质浸润、空洞、不能解释的胸膜增厚或积液。这些发现可提示但不能诊断肺癌,需要进一步的CT或PET-CT检查和细胞病理学证实。[2]。CT扫描通常用来提供更多关于癌症类型和发展程度的信息。支气管镜或CT引导下的组织活检通常用于肿瘤组织病理学检查的取样[14]。
胸片上肺癌通常表现为一个孤立性肺结节,但还需大量鉴别诊断,因为许多其它疾病也可有类似病症,包括肺结核、真菌感染、转移癌或机化性肺炎。导致单个肺结节不太常见的原因包括错构瘤、支气管源性囊肿、腺瘤、动静脉畸形、肺隔离症、类风湿结节、肉芽肿病伴多血管炎或淋巴瘤[55]。因为无关原因做胸部X片或CT扫描时,也可能看到单独肺结节而偶然发现肺癌[56]。肺癌需要通过对可疑组织的临床和影像学特征进行组织学检查方能确诊[1]。
临床实践指南推荐了肺结节的监测频率[57]。CT扫描不应使用过长时间或过于频繁,因为会增加人们接触到的射线量[57]。
分类
| 组织类型 | 每年每100,00人的发病率 |
|---|---|
| 所有类型 | 66.9 |
| 腺癌 | 22.1 |
| 鳞癌 | 14.4 |
| 小细胞癌 | 9.8 |
| 组织类型 | 免疫染色 |
|---|---|
| 鳞癌 | CK5/6 阳性 CK7 阴性 |
| 腺癌 | CK7 阳性 TTF-1 阳性 |
| 大细胞癌 | TTF-1 阴性 |
| 小细胞癌 | TTF-1 阳性 CD56 阳性 嗜铬粒蛋白 阳性 突触小泡蛋白 阳性 |
肺癌根据组织学类型分类[8]。这一分类对决定治疗措施和预测疗效很重要。肺癌是癌症——源于上皮细胞的恶性肿瘤。组织病理学家根据显微镜下观察到的癌细胞的大小和形态对肺癌进行分类。为方便治疗肺癌被分为两大类:非小细胞肺癌和小细胞肺癌[58]。
非小细胞肺癌
三种主要非小细胞肺癌是:肺腺癌,鳞状细胞癌和大细胞癌[1]。
接近40%的肺癌属于腺癌,腺癌一般起源于周围肺组织[8]。虽然多数腺癌与吸烟有关,但在那些一生抽烟少于100根(从未吸烟者)的肺癌患者中腺癌也是最常见类型[1][59]。细支气管肺泡癌是腺癌的一个亚型,在女性从未吸烟者中更常见,长期生存情况可能更好[60]。
鳞癌大概占肺癌的30%,一般位于大气道附近。癌组织中央常可发现一个空腔和相应的细胞坏死[8]。鳞癌大概占肺癌的30%。一般位于大气道附近。癌组织中央常可发现一个空腔和相应的细胞坏死。大约9%的肺癌为大细胞癌。之所以称其为大细胞癌是因为癌细胞体积大,细胞质过量,细胞核大,核仁明显[8]。
小细胞肺癌
小细胞肺癌的癌细胞内含有致密的神经内分泌颗粒(即含有神经内分泌激素的囊泡),这使该肿瘤与内分泌/副癌综合征有关[61]。多数小细胞肺癌发生在大的气道(主支气管和次级支气管)[14]。病程中癌组织生长迅速,发生扩散早,60-70%的患者就诊时已有肿瘤转移。小细胞癌和吸烟有着极大的关系[1]。
其他
公认的主要组织学亚型有四种,虽然有些癌组织包含几种不同亚型[58]。罕见的亚型包括:腺瘤,类癌瘤和未分化癌[1]。
转移
身体其它部位肿瘤常常扩散到肺部。继发性肿瘤根据其原发部位分类,如扩散到肺部的乳腺癌被称为转移性乳腺癌。转移性肿瘤在胸片中常显示为典型的圆形[62]。原发性肺癌本身最常见的转移部位是脑、骨、肝脏和肾上腺[8]。对活检组织进行免疫染色通常有助于确定癌症原发部位[63]。
分期
癌症分期是对其从原发部位扩散的程度进行评价,是影响肺癌预后和潜在治疗措施的因素之一[1]。最初对非小细胞肺癌的分期评估使用的是TNM分期法。是基于原发肿瘤的大小,是否累及淋巴结及有否远处转移[1]。
使用TNM分期系统可将肺癌分为隐匿癌,0,IA,IB,IIA,IIB,IIIA,IIIB和IV期。这一分期系统可辅助选择治疗措施和评估预后[64]。传统上小细胞肺癌被归入局限期(只限于一侧胸腔且能被纳入单一放射治疗领域)和广泛期(播散范围更广)[1]。但使用TNM系统进行分类有助于评估其预后[64]。
对非小细胞肺癌和小细胞肺癌来说有两种分期评估方法:临床分期和外科手术分期。临床分期在确定手术之前进行,以影像学检查结果(如CT扫描和PET扫描)和组织活检结果为基础。外科手术分期在术中或术后进行,综合考虑手术和临床的结果,包括对胸腔淋巴结的手术取样[8]。
| [显示]肺癌的TNM分期法[1][65] |
|---|
预防
禁烟
在大多数国家,大部分工业和家用的可致癌物质都已明确并已被禁用,然而吸烟仍很普遍。限制吸烟是预防肺癌的首要目标,而禁烟是这个过程中最重要的一环[67]。有更多西方国家通过政策干预来减少在餐馆和工作场所等公共区域的被动吸烟[68]。2005年开始不丹已实行完全禁烟令[69],且印度从2008年10月开始也实行了公共场所禁烟令[70]。世界卫生组织(WHO)号召各国政府全面禁止烟草广告以防止年轻人沾染,WHO估计在实行这种禁令的国家烟草消费量已减少了至少16%[71]。
筛查
癌症筛查采用医学检查手段在没有症状的大规模人群中进行检测[72]。对有患肺癌高风险的人群可以通过CT来筛查发现癌组织,也使病人有机会作出处理从而延长寿命[57]。这种形式的筛查使死于肺癌机率的绝对数减少了0.3%(相对数减少了20%)[73][74]。高危人群是指那些年龄为55-74岁,抽烟量相当于连续30年每天1盒,而且戒烟不超过15年的人[57]。
CT筛查假阳性率高,可能导致采取不必要的治疗措施[75]。约20%的人CT筛查为阳性,(经随访后)发现约1%为真阳性[76]。人们还担心放射线照射量[75]和检查费用[57]。研究发现其他两种可用检查方式——痰液细胞学和胸片筛查没有额外的优势。[77]。
美国预防服务工作组建议对那些有30包年(每天吸烟的平均包数乘以烟龄)吸烟史年龄介于55-80之间的人每年用低剂量CT筛查肺癌直到他们停止吸烟超过15年[78]。此CT筛查不适用于那些有其它健康问题或即使发现患肺癌后也无法治疗的人[78]。2014年,英国国家卫生署重新审查了支持进行CT筛查的证据[79]。
其他预防措施
长期补充维生素A[80][81]、C[80]、D[82]或E[80]并不会降低患肺癌的风险。一些研究表明:饮食中蔬菜和水果比例较高的人患肺癌风险会更低[22][83],但这也可能混杂了其他因素,如风险降低是因为高水果/蔬菜饮食和更少吸烟量之间的联合作用。还未有严谨的调查研究证明饮食和肺癌风险之间有明确关联[83]。
管理
肺癌的治疗取决于癌细胞的类型,扩散程度和病人的身体状况。通常的治疗措施包括:和缓医疗[84], 手术,化疗和放疗[1]。对晚期肺癌来说,靶向治疗会变得越来越重要。
手术

如果确诊为非小细胞肺癌,对其进行分期可确定肺癌病灶是否为局限性、能否手术切除或是否癌组织已扩散到无法用手术治疗的程度,这可用CT和正电子成像术(PET)扫描来决定[1]。如果怀疑纵膈淋巴结受累及可以用纵膈镜检来取样淋巴结从而协助分期[85]。血液检查和肺功能检查用于评估病人能否承受手术[14]。如果肺功能检查发现病人呼气储备量很低可能不会进行手术[1]。
对大多数早期的非小细胞肺癌患者手术会选择切除一个肺叶(肺叶切除术)。对于不适合行完整肺叶切除术的病人可能会进行更小的亚肺叶切除术(楔形切除术),但是与肺叶切除术相比楔形切除术术后更易复发[86]。在楔形切除部位的边缘进行放射性碘的近距离治疗可能会降低复发的风险[87]。全肺切除术很罕见[86]。电视辅助胸腔镜手术(VATS)和VATS肺叶切除术使用微创技术对肺癌进行手术治疗[88]。与传统的开放肺叶切除术相比VATS肺叶切除术同样有效且术后并发症更少[89]。
小细胞肺癌通常使用化疗和/或放疗[90],但是人们正重新考量手术对小细胞肺癌的作用。早期小细胞肺癌手术切除后再进行放化疗疗效可能会更好[91]。
放疗
化疗通常和放疗同时进行,对于不符合手术条件的非小细胞肺癌患者,放疗也用于治疗目的。这种高强度的放疗被称为根治性放疗[92]。连续超分割加速放疗(CHART)是对根治性放疗的改进,它在短时间内给予患者大剂量的放疗[93]。非小细胞肺癌行治疗目的的手术后一般不做胸部放疗[94],但对有纵膈N2淋巴结累及的一些患者来说术后放疗可能有好处[95]。对可能治愈的小细胞肺癌患者化疗之外通常建议进行胸部放疗[8]。
如果癌组织堵塞了一小段支气管,可以在气道内用近距离治疗(局部放疗)直接打通。和体外放射治疗相比,近距离治疗可减少治疗时间,也可减少对医护人员的射线照射量[96]。然而相比近距离治疗,有更多证据支持体外放射治疗[97]。
预防性颅脑照射(PCI)是脑部的一种放疗手段,用于降低肿瘤转移风险,对小细胞肺癌最有用。PCI使局限期肺癌的三年生存率增加15%-20%,使广泛期肺癌的一年生存率增加13-27%[98]。
近年来靶向治疗和影像技术的改进使立体定向放疗治疗早期肺癌这一疗法得到发展。这种放疗方法使用立体定向定位技术分几次对病人进行大剂量放疗。这最初用于那些由于某些合并症无法进行手术的患者[99]。
对非小细胞肺癌和小细胞肺癌患者来说稍小剂量的胸部放疗可用于控制症状(临终关怀)[100]。
射频消融术是一种利用高频电流来杀死肿瘤细胞的新技术,可以用于肿瘤病灶较小的早期患者或放疗后的复发患者。这是一种创伤较小的治疗手段,较开胸手术而言,可以尽可能多地保护肺功能,适用于无法手术的患者。[2]
化疗
化疗方案取决于肿瘤类型[8]。小细胞肺癌(SCLC)即使在相对早期也主要采用化疗和放疗进行治疗[101],常用的化疗方案为依托泊苷联合一种铂类药物(顺铂或卡铂)[102],二者也常和卡铂、吉西他滨、紫杉醇、长春瑞滨、拓扑替康、伊立替康等药物联用[103][104]。对于晚期非小细胞肺癌(NSCLC),如果病人身体可承受,化疗可提高存活率,是一线治疗手段,[105]并且通常使用两种药物来治疗,其中一种常为铂类(顺铂或卡铂)。其它常用的化疗药物为:吉西他滨、紫杉醇、多西他赛[106][107]、培美曲塞[108]、依托泊苷或长春瑞滨[107]。
辅助化疗是指手术起到明显治疗作用目的后实施的化疗,目的是提高疗效。对于非小细胞肺癌,手术过程中会在病灶旁淋巴结取样以辅助分期。如果确定其为肺癌II或III期,辅助性化疗可以使五年生存率提高5%。与旧的化疗方案相比,长春瑞滨和顺铂联用更有效[109]。对IB期肺癌是否应采用辅助性化疗还有争议,因为临床试验还未证明其可以提高生存率[110][111]。非小细胞肺癌的癌组织若能手术切除,术前化疗也能提高疗效[112]。
在对非小细胞肺癌的治疗中化疗可能会与和缓医疗联合应用。对晚期病人而言,适当的化疗比单纯的支持性护理更能提高平均存活率,也可以改善生存质量[113]。在和缓医疗的过程中如果病人身体状况允许的话,坚持化疗可以使存活时间延长1.5到3个月,也可减轻症状改善生存质量,且现代化疗药物的效果更好[114][115]。非小细胞肺癌芸萃分析协作小组建议:在晚期非小细胞肺癌的治疗中,如果患者愿意而且可忍受就应该考虑进行化疗[105][116]。
靶向治疗
肺癌、特别是在晚期肺癌的治疗中,有几种以分子路径为靶标的药物可用,厄洛替尼,吉非替尼和阿法替尼抑制表皮生长因子受体中的酪氨酸激酶。地诺单抗是抗核因子kappa-B配体的受体激动剂的单克隆抗体,可能对治疗骨转移癌有效[117]。2015年单克隆抗体药物安维汀(贝伐珠单抗)肺癌适应症在中国上市,其通过抑制肿瘤血管生成来治疗癌症[118]。
和缓医疗
通常对癌症患者进行治疗时,即使他们正在接受化疗,加入和缓医疗也会有好处[119]。这些方法使医生得以对治疗方案进行进一步探讨,经过深思熟虑后做出决定[120]。[121]不只在生命垂危时,而且在整个病程中,和缓医疗都可以避免无用但昂贵的治疗措施。对那些癌症晚期的病人,也可能较适合安宁病房[14][121]。
预后
| 临床分期 | 五年以上存活率(%) | |
|---|---|---|
| 非小细胞肺癌 | 小细胞肺癌 | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
美国所有肺癌患者中16.8%确诊后存活了至少5年[10][122]。在英国2005年到2009年之间肺癌总的五年生存率不到10%[123]。发展中国家这一情况更糟糕,确诊时往往已是晚期[124]。就诊时30-40%的非小细胞肺癌已是Ⅳ期,60%的小细胞肺癌也已发展到Ⅳ期[8]。确诊时分期越晚肺癌患者存活时间越短,英国的数据表明:确诊时处于最早期的病人中70%可以存活至少1年,但对那些确诊时处于最晚期的病人这一数字下降到只有14%[125]。
非小细胞肺癌的预后影响因素包括有无肺部症状,肿瘤大小,细胞类型(组织学),扩散程度(分期)和是否转移到多处淋巴结,有无血管侵袭。不能进行手术的病人中身体状况差且体重下降超过10%者预后更差。[126]小细胞肺癌的预后影响因素包括:身体状况,性别,癌症分期,还有确诊时癌细胞是否累及中枢神经系统或者肝脏[127]。
对于非小细胞肺癌,若IA期时手术完整切除癌灶预后最好,多达70%患者可存活5年[128]。小细胞肺癌的五年存活率总共约为5%[1]。晚期小细胞肺癌患者平均五年生存率不到1%。局限期患者的平均生存时间是20个月,五年生存率为20%[2]。
根据美国国家癌症研究所提供的数据,美国肺癌患者确诊时的年龄中位数为70岁[129],死亡年龄中位数为72岁[130];有医疗保险的人可能预后更好[131]。
流行病学
|
无数据
≤ 5
5-10
10-15
15-20
20-25
25-30
|
30-35
35-40
40-45
45-50
50-55
≥ 55
|
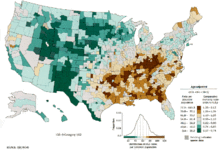
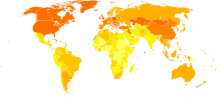
世界范围内男性中发病率和致死率最高的癌症是肺癌,女性中肺癌发病率居第三位,死亡率居第二位,仅次于乳癌。2012年,全球有182万新增肺癌患者,156万最终死于肺癌,占了因癌症死亡人数的19.4%[11]。肺癌发病率最高的是北美,欧洲和东亚,2012年,超过三分之一的新增患者出现在中国,而非洲和南亚肺癌发病率则要低得多[133]。在英国肺癌是第二大最常见癌症(2011年有大约43500人被诊断为肺癌),也是癌症致死的最常见病因(2012年大约35400人死于肺癌)[134]。
年龄超过50岁有吸烟史的人群可能最容易患肺癌。和20多年前就开始下降的男性肺癌死亡率相比,女性的肺癌死亡率过去数十年一直在上升,最近才趋于稳定[135]。在美国,男性一生中患肺癌的风险是8%,女性是6%[1]。
每抽掉300到400万根香烟就有一个人死于肺癌[1][136]。大烟草公司的影响力在吸烟文化中发挥重要作用[137]。看到烟草广告的年轻的非吸烟者更有可能开始吸烟[138]。人们越来越关注被动吸烟作为肺癌的危险因素[25],以致政府进行政策干预以减少非吸烟者不想要的暴露于其他人的烟草烟雾中的几率[139]。汽车、工厂、发电厂排放的废气也造成了潜在的风险[4]。
东欧男性的肺癌死亡率最高,而北欧和美国女性的肺癌死亡率最高。美国黑人男性和女性的发病率都更高[140]。发展中国家肺癌的发病率目前要低些[141],随着发展中国家吸烟的人越来越多,人们预期在接下来的几年肺癌发病率会上升,尤其是中国[142]和印度[143]。
从19世纪60年代开始,相对于其他类型肺癌,肺腺癌的发病率开始上升,部分原因是过滤嘴香烟的面世。过滤嘴过滤掉了烟草中的大颗粒物,因此减少了大气道中的沉积物。但是抽烟者必须吸得更深以获得等量的尼古丁,因此沉积在小气道的颗粒物就增加了,而那里正是肺腺癌易发部位[144]。肺腺癌的发病率还在持续上升[145]。
历史
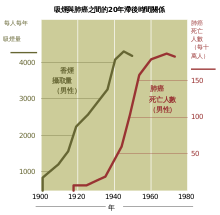
在抽烟出现之前肺癌很少见;在1761年之前,人们甚至不认为肺癌是一个明确的疾病[146]。肺癌的各个方面在1810年得以详细记述[147]。在1878年,尸检时发现的癌症中恶性肺肿瘤仅占1%,但到20世纪早期,这一比例已上升到10-15%[148]。在1912年,全世界医学文献中的肺癌病例报告只有374例[149],但是一篇尸检的综述表明肺癌的发病率已经从1852年的0.3%上升到了1952年的5.66%[150]。1929年,德国内科医生弗里茨·利金特意识到了吸烟和肺癌的直接关联[148],这导致了一场激进的反吸烟运动[151]。在20世纪50年代发表的对英国医生吸烟和肺癌的研究结果,第一次为吸烟和肺癌之间的关联提供了确凿的流行病学证据[152]。因此在1964年美国军医署建议吸烟者戒烟[153]。
在萨克森州施内贝格附近的厄尔士山脉工作的矿工中,人们第一次意识到肺癌和氡气之间的关联,那里1740年就开始开采银矿,这些矿富含铀,也附带有镭和氡气[154]。矿工中很多人患了肺部疾病,直到19世纪70年代才意识到是肺癌[155]。尽管发现了这些问题,但由于苏联对铀的需求,开采还是持续到了20世纪50年代[154]。20世纪60年代,氡被确认为肺癌的一个致病因素[156]。
用于治疗肺癌的全肺切除术在1933年首次成功实施[157]。姑息放疗从20世纪40年代开始使用[158],从20世纪50年代开始使用根治性放疗,即尝试对那些处于肺癌早期但不适合手术治疗的病人使用更大的放射剂量[159]。在1997年,连续超分割加速放疗法出现,这被认为是对传统的根治性放疗的改进[160]。对小细胞肺癌,20世纪60年代开始尝试手术切除[161]和根治性放疗[162]但不成功。至20世纪70年代才开发出了成功的化疗方案[163]。
研究方向
当前肺癌治疗的研究方向包括免疫治疗[164](激活机体免疫系统攻击肿瘤细胞)、表观遗传学、化疗和放疗新组合(单独或联合)。这些新的治疗措施中很多是通过阻断免疫关卡,干扰癌细胞逃避免疫系统攻击的能力[164]。
T细胞上的受体CTLA-4会抑制免疫系统,伊匹单抗通过作用于它阻断其信号传导。FDA已批准其用于治疗黑色素瘤,使用伊匹单抗治疗非小细胞肺癌和小细胞肺癌的临床试验也正在进行[164]。
其它免疫疗法是通过干扰程序性细胞死亡1(PD-1)蛋白与其配体PD-1配体1(PD-L1)来发挥疗效。通过PD-1传导的信号可使T细胞失活,一些癌细胞似乎利用了这点通过表达PD-L1以免受T细胞威胁。使用针对PD-1和PD-L1的单克隆抗体(如派姆单抗和nivolumab)[165]治疗肺癌[164]的临床试验目前正在进行。
表观遗传学研究微观、通常可遗传的结合DNA及修饰基因表达水平的“分子水平的修饰”(或称为“标签”)。针对这些‘标签’的药物可以杀死癌细胞而且副作用更少。研究也显示在对病人进行标准化治疗前给他们用这些药可以提高效果[166]。开发中的组蛋白脱乙酰酶抑制剂包括丙戊酸,伏立诺他、belinostat、帕比司他、恩替诺特和罗醚酯肽。开发中的DNA甲基转移酶抑制剂包括地西他滨、氮杂胞苷和肼屈嗪[52]。
TRACERx项目正在观察非小细胞肺癌如何形成和发展,以及这些肿瘤如何变得对治疗耐受[167]。这一项目会观察来自850例非小细胞肺癌病人的肿瘤样本,这些病人处于确诊后、初次治疗后、治疗后、和复发后等各个时期[168]。通过分析肿瘤发展不同阶段的样本,研究者们希望找出哪些变化能够加速肿瘤的生长,加强肿瘤对治疗的耐受性。该项目的结果能够帮助科学家和医生更好地理解非小细胞肺癌,并且可能有助于发现治疗肺癌的新的手段[167]。
有些肺癌患者对表皮生长因子受体(EGFR)和间变性淋巴瘤激酶(ALK)的酪氨酸激酶抑制剂形成耐受,对此正在开发新药。新的EGFR抑制剂包括阿法替尼和Dacomitinib。tivantinib和onartuzumab则可抑制另一信号通路c-Met。新的ALK抑制剂包括克里唑替尼和色瑞替尼[169]。
引用
- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 1.23 1.24 1.25 Horn, L; Pao W; Johnson DH. Chapter 89. (编) Longo, DL; Kasper, DL; Jameson, JL; Fauci, AS; Hauser, SL; Loscalzo, J. Harrison's Principles of Internal Medicine 18th. McGraw-Hill. 2012. ISBN 0-07-174889-X.
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 Lung Carcinoma: Tumors of the Lungs. Merck Manual Professional Edition, Online edition. [2007-08-15].
- ^ Thun MJ, Hannan LM, Adams-Campbell LL et al. Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies. PLoS Medicine. 2008-09, 5 (9): e185. doi:10.1371/journal.pmed.0050185. PMC 2531137. PMID 18788891.
- ^ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 Alberg AJ, Samet JM. Chapter 46. Murray & Nadel's Textbook of Respiratory Medicine 5th. Saunders Elsevier. 2010. ISBN 978-1-4160-4710-0.
- ^ 5.0 5.1 O'Reilly, KM; Mclaughlin AM; Beckett WS; Sime PJ. Asbestos-related lung disease. American Family Physician. 2007-03, 75 (5): 683–688. PMID 17375514.
- ^ Carmona, RH. The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General. U.S. Department of Health and Human Services. 2006-06-27 [2014-06-16]. "Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke."
- ^ Tobacco Smoke and Involuntary Smoking (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans (WHO International Agency for Research on Cancer). 2002, 83. "There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. ... Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1)."
- ^ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 8.10 Lu C, Onn A, Vaporciyan AA et al. 78: Cancer of the Lung. Holland-Frei Cancer Medicine 8th. People's Medical Publishing House. 2010. ISBN 978-1-60795-014-1.
- ^ Chapman, S; Robinson G; Stradling J; West S. Chapter 31. Oxford Handbook of Respiratory Medicine 2nd. Oxford University Press. 2009. ISBN 978-0-19-954516-2.
- ^ 10.0 10.1 Surveillance, Epidemiology and End Results Program. National Cancer Institute. [2014-07-15].
- ^ 11.0 11.1 World Cancer Report 2014. World Health Organization. 2014: Chapter 1.1. ISBN 9283204298.
- ^ Honnorat, J; Antoine JC. Paraneoplastic neurological syndromes. Orphanet Journal of Rare Diseases (BioMed Central). 2007-05, 2 (1): 22. doi:10.1186/1750-1172-2-22. PMC 1868710. PMID 17480225.
- ^ 13.0 13.1 Greene, Frederick L. AJCC cancer staging manual. Berlin: Springer-Verlag. 2002. ISBN 0-387-95271-3.
- ^ 14.0 14.1 14.2 14.3 14.4 Collins, LG; Haines C; Perkel R; Enck RE. Lung cancer: diagnosis and management. American Family Physician (American Academy of Family Physicians). 2007-01, 75 (1): 56–63. PMID 17225705.
- ^ Brown KM, Keats JJ, Sekulic A et al. Chapter 8. Holland-Frei Cancer Medicine 8th. People's Medical Publishing House USA. 2010. ISBN 978-1-60795-014-1.
- ^ Biesalski HK, Bueno de Mesquita B, Chesson A et al. European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel. CA Cancer J Clin (Smoking is the major risk factor, accounting for about 90% of lung cancer incidence.). 1998, 48 (3): 167–176; discussion 164–166. doi:10.3322/canjclin.48.3.167. PMID 9594919.
- ^ 17.0 17.1 Hecht, SS. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 2012, 131 (12): 2724–2732. doi:10.1002/ijc.27816. PMC 3479369. PMID 22945513.
- ^ Kumar, V; Abbas AK; Aster JC. Chapter 5. Robbins Basic Pathology 9th. Elsevier Saunders. 2013: 199. ISBN 978-1-4377-1781-5.
- ^ Peto R, Lopez AD, Boreham J et al. Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press. 2006. ISBN 0-19-262535-7.
- ^ California Environmental Protection Agency. Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency. Tobacco Control. 1997, 6 (4): 346–353. doi:10.1136/tc.6.4.346. PMC 1759599. PMID 9583639.
- ^ Centers for Disease Control and Prevention (CDC). State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000. Morbidity and Mortality Weekly Report (Atlanta, Georgia: CDC). 2001-12, 50 (49): 1101–1106. PMID 11794619.
- ^ 22.0 22.1 22.2 Alberg, AJ; Samet JM. Epidemiology of lung cancer. Chest (American College of Chest Physicians). 2007-09, 132 (S3): 29S–55S. doi:10.1378/chest.07-1347. PMID 17873159.
- ^ Jaakkola, MS; Jaakkola JJ. Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention. European Respiratory Journal. 2006-08, 28 (2): 397–408. doi:10.1183/09031936.06.00001306. PMID 16880370.
- ^ Parkin, DM. Tobacco—attributable cancer burden in the UK in 2010. British Journal of Cancer. 2011-12, 105 (Suppl. 2): S6–S13. doi:10.1038/bjc.2011.475. PMC 3252064. PMID 22158323.
- ^ 25.0 25.1 Taylor, R; Najafi F; Dobson A. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. International Journal of Epidemiology. 2007-10, 36 (5): 1048–1059. doi:10.1093/ije/dym158. PMID 17690135.
- ^ Frequently asked questions about second hand smoke. World Health Organization. [2012-07-25].
- ^ Schick, S; Glantz S. Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke. Tobacco Control. 2005-12, 14 (6): 396–404. doi:10.1136/tc.2005.011288. PMC 1748121. PMID 16319363.
- ^ Greydanus, DE; Hawver EK; Greydanus MM. Marijuana: current concepts. Frontiers in Public Health. 2013-10, 1 (42). doi:10.3389/fpubh.2013.00042. PMC 3859982. PMID 24350211.
- ^ Owen, KP; Sutter, ME; Albertson, TE. Marijuana: respiratory tract effects.. Clinical reviews in allergy & immunology. 2014-02, 46 (1): 65–81. doi:10.1007/s12016-013-8374-y. PMID 23715638.
- ^ Joshi, M; Joshi, A; Bartter, T. Marijuana and lung diseases.. Current Opinion in Pulmonary Medicine. 2014-03, 20 (2): 173–179. doi:10.1097/mcp.0000000000000026. PMID 24384575.
- ^ Tashkin, DP. Effects of marijuana smoking on the lung.. Annals of the American Thoracic Society. 2013-06, 10 (3): 239–47. doi:10.1513/annalsats.201212-127fr. PMID 23802821.
- ^ Underner, M; Urban T; Perriot J. Cannabis smoking and lung cancer. Revue des Maladies Respiratoires. 2014-06, 31 (6): 488–498. doi:10.1016/j.rmr.2013.12.002. PMID 25012035.
- ^ Choi, H; Mazzone, P. Radon and lung cancer: assessing and mitigating the risk. Cleveland Clinic Journal of Medicine. 2014-09, 81 (9): 567–575. doi:10.3949/ccjm.81a.14046. PMID 25183848.
- ^ Radon (Rn) Health Risks. EPA.
- ^ Schmid K, Kuwert T, Drexler H. Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine. Dtsch Arztebl Int. 2010-03, 107 (11): 181–6. doi:10.3238/arztebl.2010.0181. PMC 2853156. PMID 20386676.
- ^ EPA. Radiation information: radon. EPA. 2013-02.
- ^ Tobias, J; Hochhauser D. Chapter 12. Cancer and its Management 6th. Wiley-Blackwell. 2010: 199. ISBN 978-1405-170154.
- ^ Davies, RJO; Lee YCG. 18.19.3. Oxford Textbook Medicine 5th. OUP Oxford. 2010. ISBN 978-0-19-920485-4.
- ^ Chen, H; Goldberg MS; Villeneuve PJ. A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases. Reviews on Environmental Health. 2008-10–12, 23 (4): 243–297. doi:10.1515/reveh.2008.23.4.243. PMID 19235364.
- ^ Clapp, RW; Jacobs MM; Loechler EL. Environmental and Occupational Causes of Cancer New Evidence, 2005–2007. Reviews on Environmental Health. 2008-01–03, 23 (1): 1–37. doi:10.1515/REVEH.2008.23.1.1. PMC 2791455. PMID 18557596.
- ^ 41.0 41.1 Lim, WY; Seow, A. Biomass fuels and lung cancer.. Respirology (Carlton, Vic.). 2012-01, 17 (1): 20–31. doi:10.1111/j.1440-1843.2011.02088.x. PMID 22008241.
- ^ 42.0 42.1 Sood, A. Indoor fuel exposure and the lung in both developing and developed countries: an update.. Clinics in chest medicine. 2012-12, 33 (4): 649–65. doi:10.1016/j.ccm.2012.08.003. PMID 23153607.
- ^ Yang, IA; Holloway, JW; Fong, KM. Genetic susceptibility to lung cancer and co-morbidities. Journal of Thoracic Disease. 2013-10, 5 (Suppl. 5): S454–S462. doi:10.3978/j.issn.2072-1439.2013.08.06. PMC 3804872. PMID 24163739.
- ^ Kern JA, McLennan G. Fishman's Pulmonary Diseases and Disorders 4th. McGraw-Hill. 2008: 1802. ISBN 0-07-145739-9.
- ^ Larsen, JE; Minna D. Molecular biology of lung cancer: clinical implications. Clinics in Chest Medicine. 2011-12, 32 (4): 703–740. doi:10.1016/j.ccm.2011.08.003. PMC 3367865. PMID 22054881.
- ^ Cogliano, VJ; Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, CP. Preventable exposures associated with human cancers.. Journal of the National Cancer Institute. 2011-12-21, 103 (24): 1827–39. doi:10.1093/jnci/djr483. PMID 22158127.
- ^ Cooper, WA; Lam DLC; O'Toole SA. Molecular biology of lung cancer. Journal of Thoracic Disease. 2013-10, 5 (Suppl. 5): S. 479–490. doi:10.3978/j.issn.2072-1439.2013.08.03. PMC 3804875. PMID 24163741.
- ^ Tobias, J; Hochhauser D. Chapter 12. Cancer and its Management 6th. Wiley-Blackwell. 2010: 200. ISBN 978-1405-170154.
- ^ 49.0 49.1 49.2 49.3 Herbst, RS; Heymach JV; Lippman SM. Lung cancer. New England Journal of Medicine. 2008-09, 359 (13): 1367–1380. doi:10.1056/NEJMra0802714. PMID 18815398.
- ^ Aviel-Ronen, S; Blackhall FH; Shepherd FA; Tsao MS. K-ras mutations in non-small-cell lung carcinoma: a review. Clinical Lung Cancer (Cancer Information Group). 2006-07, 8 (1): 30–38. doi:10.3816/CLC.2006.n.030. PMID 16870043.
- ^ Kumar, V; Abbas AK; Aster JC. Chapter 5. Robbins Basic Pathology 9th. Elsevier Saunders. 2013: 212. ISBN 978-1-4377-1781-5.
- ^ 52.0 52.1 Jakopovic, M; Thomas A; Balasubramaniam S. Targeting the epigenome in lung cancer: expanding approaches to epigenetic therapy. Frontiers in Oncology. 2013-10, 3 (261). doi:10.3389/fonc.2013.00261. PMC 3793201. PMID 24130964.
- ^ 53.0 53.1 Mulvihill, MS; Kratz JR; Pham P. The role of stem cells in airway repair: implications for the origins of lung cancer. Chinese Journal of Cancer. 2013-02, 32 (2): 71–74. doi:10.5732/cjc.012.10097. PMC 3845611. PMID 23114089.
- ^ Powell, CA; Halmos B; Nana-Sinkam SP. Update in lung cancer and mesothelioma 2012. American Journal of Respiratory and Critical Care Medicine. 2013-07, 188 (2): 157–166. doi:10.1164/rccm.201304-0716UP. PMC 3778761. PMID 23855692.
- ^ Miller, WT. Fishman's Pulmonary Diseases and Disorders 4th. McGraw-Hill. 2008: 486. ISBN 0-07-145739-9.
- ^ Kaiser, LR. Fishman's Pulmonary Diseases and Disorders 4th. McGraw-Hill. 2008: 1815–1816. ISBN 0-07-145739-9.
- ^ 57.0 57.1 57.2 57.3 57.4 American College of Chest Physicians; American Thoracic Society, Five Things Physicians and Patients Should Question, Choosing Wisely: an initiative of the ABIM Foundation (American College of Chest Physicians and American Thoracic Society), 2013-09 [2013-01-06]
- ^ 58.0 58.1 Kumar, V; Abbas AK; Aster JC. 12. Robbins Basic Pathology 9th. Elsevier Saunders. 2013: 505. ISBN 978-1-4377-1781-5.
- ^ Subramanian, J; Govindan R. Lung cancer in never smokers: a review. Journal of Clinical Oncology (American Society of Clinical Oncology). 2007-02, 25 (5): 561–570. doi:10.1200/JCO.2006.06.8015. PMID 17290066.
- ^ Raz, DJ; He B; Rosell R; Jablons DM. Bronchioloalveolar carcinoma: a review. Clinical Lung Cancer. 2006-03, 7 (5): 313–322. doi:10.3816/CLC.2006.n.012. PMID 16640802.
- ^ Rosti G, Bevilacqua G, Bidoli P et al. Small cell lung cancer. Annals of Oncology. 2006-03, 17 (Suppl. 2): 5–10. doi:10.1093/annonc/mdj910. PMID 16608983.
- ^ Seo JB, Im JG, Goo JM et al. Atypical pulmonary metastases: spectrum of radiologic findings. Radiographics. 2001-03-01, 21 (2): 403–417. doi:10.1148/radiographics.21.2.g01mr17403. PMID 11259704.
- ^ Tan D, Zander DS. Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update. Int J Clin Exp Pathol. 2008, 1 (1): 19–31. PMC 2480532. PMID 18784820.
- ^ 64.0 64.1 64.2 Rami-Porta, R; Crowley JJ; Goldstraw P. The revised TNM staging system for lung cancer. Annals of Thoracic and Cardiovascular Surgery. 2009-02, 15 (1): 4–9. PMID 19262443.
- ^ Chheang, S; Brown K. Lung cancer staging: clinical and radiologic perspectives. Seminars in Interventional Radiology. 2013-06, 30 (2): 99–113. doi:10.1055/s-0033-1342950. PMC 3709937. PMID 24436525.
- ^ Dela Cruz, CS; Tanoue LT; Matthay RA. Lung cancer: epidemiology, etiology, and prevention. Clinic in Chest Medicine. 2011-12, 32 (4): 605–644. doi:10.1016/j.ccm.2011.09.001. PMC 3864624. PMID 22054876.
- ^ Goodman, GE. Lung cancer. 1: prevention of lung cancer. Thorax. 2002-11, 57 (11): 994–999. doi:10.1136/thorax.57.11.994. PMC 1746232. PMID 12403886.
- ^ McNabola, A; Gill LW. The control of environmental tobacco smoke: a policy review. International Journal of Environmental Research and Public Health. 2009-02, 6 (2): 741–758. doi:10.3390/ijerph6020741. PMC 2672352. PMID 19440413.
- ^ Pandey, G. Bhutan's smokers face public ban. BBC. 2005-02 [2007-09-07].
- ^ Pandey, G. Indian ban on smoking in public. BBC. 2008-10-02 [2012-04-25].
- ^ UN health agency calls for total ban on tobacco advertising to protect young, 新闻稿. 联合国 News service. 2008-05-30.
- ^ Gutierrez, A; Suh R; Abtin F. Lung cancer screening. Seminars in Interventional Radiology. 2013-06, 30 (2): 114–120. doi:10.1055/s-0033-1342951. PMC 3709936. PMID 24436526.
- ^ Jaklitsch MT, Jacobson FL, Austin JH et al. The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups. Journal of Thoracic and Cardiovascular Surgery. 2012-07, 144 (1): 33–38. doi:10.1016/j.jtcvs.2012.05.060. PMID 22710039.
- ^ Bach PB, Mirkin JN, Oliver TK et al. Benefits and harms of CT screening for lung cancer: a systematic review. JAMA: the Journal of the American Medical Association. 2012-06, 307 (22): 2418–2429. doi:10.1001/jama.2012.5521. PMC 3709596. PMID 22610500.
- ^ 75.0 75.1 Aberle, D. R.; Abtin, F.; Brown, K. Computed Tomography Screening for Lung Cancer: Has It Finally Arrived? Implications of the National Lung Screening Trial. Journal of Clinical Oncology. 2013, 31 (8): 1002–1008. doi:10.1200/JCO.2012.43.3110. ISSN 0732-183X.
- ^ Bach PB, Mirkin JN, Oliver TK, et al. Benefits and harms of CT screening for lung cancer: a systematic review. JAMA. 2012-06, 307 (22): 2418–29. doi:10.1001/jama.2012.5521. PMC 3709596. PMID 22610500.
- ^ Manser R, Lethaby A, Irving LB, Stone C, Byrnes G, Abramson MJ, Campbell D. Screening for lung cancer. Cochrane Database of Systematic Reviews. 2013, (6): CD001991. doi:10.1002/14651858.CD001991.pub3. PMID 23794187.
- ^ 78.0 78.1 Moyer, VA; U.S. Preventive Services Task, Force. Screening for lung cancer: U.S. Preventive Services Task Force recommendation statement.. Annals of internal medicine. 2014-05-04, 160 (5): 330–8. doi:10.7326/M13-2771. PMID 24378917.
- ^ Baldwin, DR; Hansell, DM; Duffy, SW; Field, JK. Lung cancer screening with low dose computed tomography.. BMJ (Clinical research ed.). 2014-05-07, 348: g1970. doi:10.1136/bmj.g1970. PMID 24609921.
- ^ 80.0 80.1 80.2 Fabricius, P; Lange P. Diet and lung cancer. Monaldi Archives for Chest Disease. 2003-07–09 2003, 59 (3): 207–211. PMID 15065316.
- ^ Fritz H, Kennedy D, Fergusson D et al. Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis. PLoS ONE. 2011, 6 (6): e21107. doi:10.1371/journal.pone.0021107. PMC 3124481. PMID 21738614.
- ^ Herr C, Greulich T, Koczulla RA et al. The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer. Respiratory Research. 2011-03, 12 (1): 31. doi:10.1186/1465-9921-12-31. PMC 3071319. PMID 21418564.
- ^ 83.0 83.1 Key, TJ. Fruit and vegetables and cancer risk. British Journal of Cancer. 2011-01, 104 (1): 6–11. doi:10.1038/sj.bjc.6606032. PMC 3039795. PMID 21119663.
- ^ Ferrell, B; Koczywas M; Grannis F; Harrington A. Palliative care in lung cancer. Surgical Clinics of North America. 2011-04, 91 (2): 403–417. doi:10.1016/j.suc.2010.12.003. PMID 21419260.
- ^ Kaiser LR. Fishman's Pulmonary Diseases and Disorders 4th. McGraw-Hill. 2008: 1853–1854. ISBN 0-07-145739-9.
- ^ 86.0 86.1 Kaiser LR. Fishman's Pulmonary Diseases and Disorders 4th. McGraw-Hill. 2008: 1855–1856. ISBN 0-07-145739-9.
- ^ Odell, DD; Kent MS; Fernando HC. Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer. Seminars in Thoracic and Cardiovascular Surgery. 2010-01–03, 22 (1): 32–37. doi:10.1053/j.semtcvs.2010.04.003. PMID 20813314.
- ^ Alam, N; Flores RM. Video-assisted thoracic surgery (VATS) lobectomy: the evidence base. Journal of the Society of Laparoendoscopic Surgeons. 2007-07–09, 11 (3): 368–374. PMC 3015831. PMID 17931521.
- ^ Rueth, NM; Andrade RS. Is VATS lobectomy better: perioperatively, biologically and oncologically?. Annals of Thoracic Surgery. 2010-06, 89 (6): S2107–S2111. doi:10.1016/j.athoracsur.2010.03.020. PMID 20493991.
- ^ Simon GR, Turrisi A. Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest. 2007, 132 (3 Suppl): 324S–339S. doi:10.1378/chest.07-1385. PMID 17873178.
- ^ Goldstein, SD; Yang SC. Role of surgery in small cell lung cancer. Surgical Oncology Clinics of North America. 2011-10, 20 (4): 769–777. doi:10.1016/j.soc.2011.08.001. PMID 21986271.
- ^ Arriagada, R; Goldstraw P; Le Chevalier T. Oxford Textbook of Oncology 2nd. Oxford University Press. 2002: 2094. ISBN 0-19-262926-3.
- ^ Hatton, MQ; Martin JE. Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions. Clinical Oncology (Royal College of Radiologists). 2010-06, 22 (5): 356–364. doi:10.1016/j.clon.2010.03.010. PMID 20399629.
- ^ PORT Meta-analysis Trialists Group. Postoperative radiotherapy for non-small cell lung cancer. (编) Rydzewska, Larysa. Cochrane Database of Systematic Reviews. 2005, (2): CD002142. doi:10.1002/14651858.CD002142.pub2. PMID 15846628.
- ^ Le Péchoux, C. Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data. Oncologist. 2011, 16 (5): 672–681. doi:10.1634/theoncologist.2010-0150. PMC 3228187. PMID 21378080.
- ^ Ikushima, H. Radiation therapy: state of the art and the future. Journal of Medical Investigation. 2010-02, 57 (1–2): 1–11. doi:10.2152/jmi.57.1. PMID 20299738.
- ^ Reveiz, L; Rueda, JR; Cardona, AF. Palliative endobronchial brachytherapy for non-small cell lung cancer. The Cochrane database of systematic reviews. 2012-12-12, 12: CD004284. PMID 23235606.
- ^ Paumier, A; Cuenca X; Le Péchoux C. Prophylactic cranial irradiation in lung cancer. Cancer Treatment Reviews. 2011-06, 37 (4): 261–265. doi:10.1016/j.ctrv.2010.08.009. PMID 20934256.
- ^ Girard, N; Mornex F. Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update. Cancer Radiothérapie. 2011-10, 15 (6–7): 522–526. doi:10.1016/j.canrad.2011.07.241. PMID 21889901.
- ^ Fairchild A, Harris K, Barnes E et al. Palliative thoracic radiotherapy for lung cancer: a systematic review. Journal of Clinical Oncology. 2008-08, 26 (24): 4001–4011. doi:10.1200/JCO.2007.15.3312. PMID 18711191.
- ^ Hann CL, Rudin CM. Management of small-cell lung cancer: incremental changes but hope for the future. Oncology (Williston Park). 2008-11-30, 22 (13): 1486–92. PMID 19133604.
- ^ Murray, N; Turrisi AT. A review of first-line treatment for small-cell lung cancer. Journal of Thoracic Oncology. 2006-03, 1 (3): 270–278. PMID 17409868.
- ^ Azim, HA; Ganti AK. Treatment options for relapsed small-cell lung cancer. Anticancer drugs. 2007-03, 18 (3): 255–261. doi:10.1097/CAD.0b013e328011a547. PMID 17264756.
- ^ MacCallum, C; Gillenwater HH. Second-line treatment of small-cell lung cancer. Current Oncology Reports. 2006-07, 8 (4): 258–264. doi:10.1007/s11912-006-0030-8. PMID 17254525.
- ^ 105.0 105.1 NSCLC Meta-Analyses Collaborative Group. Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials. J. Clin. Oncol. 2008-10, 26 (28): 4617–25. doi:10.1200/JCO.2008.17.7162. PMC 2653127. PMID 18678835.
- ^ Mehra R, Treat J. Fishman's Pulmonary Diseases and Disorders 4th. McGraw-Hill. 2008: 1876. ISBN 0-07-145739-9.
- ^ 107.0 107.1 Clegg A, Scott DA, Hewitson P et al. Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review. Thorax (BMJ Publishing Group). 2002-01, 57 (1): 20–28. doi:10.1136/thorax.57.1.20. PMC 1746188. PMID 11809985.
- ^ Fuld AD, Dragnev KH, Rigas JR. Pemetrexed in advanced non-small-cell lung cancer. Expert Opin Pharmacother. 2010-06, 11 (8): 1387–402. doi:10.1517/14656566.2010.482560. PMID 20446853.
- ^ Le Chevalier, T. Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?. Annals of Oncology. 2010-10, 21 (Suppl. 7): vii196–198. doi:10.1093/annonc/mdq376. PMID 20943614.
- ^ Horn, L; Sandler AB; Putnam JB Jr; Johnson DH. The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer. Journal of Thoracic Oncology. 2007-05, 2 (5): 377–383. doi:10.1097/01.JTO.0000268669.64625.bb. PMID 17473651.
- ^ Wakelee, HA; Schiller JH; Gandara DR. Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial. Clinical Lung Cancer (Cancer Information Group). 2006-07, 8 (1): 18–21. doi:10.3816/CLC.2006.n.028. PMID 16870041.
- ^ NSCLC Meta-analysis Collaborative, Group. Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet. 2014-05-03, 383 (9928): 1561–71. doi:10.1016/S0140-6736(13)62159-5. PMC 4022989. PMID 24576776.
- ^ Souquet PJ, Chauvin F, Boissel JP, Bernard JP. Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer. Lung Cancer. 1995-04,. 12 Suppl 1: S147–54. doi:10.1016/0169-5002(95)00430-9. PMID 7551923.
- ^ Sörenson S, Glimelius B, Nygren P. A systematic overview of chemotherapy effects in non-small cell lung cancer. Acta Oncologica. 2001, 40 (2–3): 327–39. doi:10.1080/02841860151116402. PMID 11441939.
- ^ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N. A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer. Health Technology Assessment. 2001, 5 (32): 1–195. PMID 12065068.
- ^ Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. The Cochrane database of systematic reviews. 2010-05-12 2010, (5): CD007309. doi:10.1002/14651858.CD007309.pub2. PMID 20464750.
- ^ D'Antonio; Passaro A; Gori B. Bone and brain metastasis in lung cancer: recent advances in therapeutic strategies. Therapeutic Advances in Medical Oncology. 2014-05, 6 (3): 101–114. doi:10.1177/1758834014521110. PMC 3987652. PMID 24790650.
- ^ 安维汀正式在华上市 将为中国患者打开希望之门. [2015-08-09].
- ^ Parikh, RB; Kirch, RA; Smith, TJ; Temel, JS. Early specialty palliative care--translating data in oncology into practice.. The New England Journal of Medicine. 2013-12-12, 369 (24): 2347–51. doi:10.1056/nejmsb1305469. PMC 3991113. PMID 24328469.
- ^ Kelley AS, Meier DE. Palliative care—a shifting paradigm. New England Journal of Medicine. 2010-08, 363 (8): 781–2. doi:10.1056/NEJMe1004139. PMID 20818881.
- ^ 121.0 121.1 Prince-Paul M. When hospice is the best option: an opportunity to redefine goals. Oncology (Williston Park, N.Y.). 2009-04, 23 (4 Suppl Nurse Ed): 13–7. PMID 19856592.
- ^ Ridge, CA; McErlean AM; Ginsberg MS. Epidemiology of lung cancer. Seminars in Interventional Radiology. 2013-06, 30 (2): 93–98. doi:10.1055/s-0033-1342949. PMC 3709917. PMID 24436524.
- ^ Lung cancer survival statistics. Cancer Research UK.
- ^ Majumder, edited by Sadhan. Stem cells and cancer Online-Ausg. New York: Springer. 2009: 193. ISBN 978-0-387-89611-3.
- ^ Lung cancer survival statistics. [2014-10-28].
- ^ Non-Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute. [2008-11-22].
- ^ Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute. 2012 [2012-05-16].
- ^ Spiro, SG. 18.19.1. Oxford Textbook Medicine 5th. OUP Oxford. 2010. ISBN 978-0-19-920485-4.
- ^ SEER data (SEER.cancer.gov) Median Age of Cancer Patients at Diagnosis 2002–2003
- ^ SEER data (SEER.cancer.gov) Median Age of Cancer Patients at Death 2002–2006
- ^ Slatore, CG; Au DH; Gould MK. An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes. American Journal of Respiratory and Critical Care Medicine. 2010-11, 182 (9): 1195–1205. doi:10.1164/rccm.2009-038ST. PMID 21041563.
- ^ WHO Disease and injury country estimates. World Health Organization. 2009 [2009-11-11].
- ^ Stewart, edited by Bernard W.; Wild, Christopher P. World cancer report 2014. Lyon: IARC Press. 2014: 350–352. ISBN 9789283204299.
- ^ Lung cancer statistics. Cancer Research UK. [2014-10-28].
- ^ Jemal A, Tiwari RC, Murray T, et al. Cancer statistics, 2004. CA: a Cancer Journal for Clinicians. 2004, 54 (1): 8–29. doi:10.3322/canjclin.54.1.8. PMID 14974761.
- ^ Proctor, RN. The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll. Tobacco Control. 2012-03, 21 (2): 87–91. doi:10.1136/tobaccocontrol-2011-050338. PMID 22345227.
- ^ Lum, KL; Polansky JR; Jackler RK; Glantz SA. Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951. Tobacco Control. 2008-10, 17 (5): 313–323. doi:10.1136/tc.2008.025445. PMC 2602591. PMID 18818225.
- ^ Lovato, C; Watts A; Stead LF. Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours. Cochrane Database of Systematic Reviews. 2011-10, (10): CD003439. doi:10.1002/14651858.CD003439.pub2. PMID 21975739.
- ^ Kemp, FB. Smoke free policies in Europe. An overview. Pneumologia. 2009-07–09, 58 (3): 155–158. PMID 19817310.
- ^ SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. National Cancer Institute. 2010.
- ^ Gender in lung cancer and smoking research (PDF). World Health Organization. 2004 [2007-05-26].
- ^ Zhang, J; Ou JX; Bai CX. Tobacco smoking in China: prevalence, disease burden, challenges and future strategies. Respirology. 2011-11, 16 (8): 1165–1172. doi:10.1111/j.1440-1843.2011.02062.x. PMID 21910781.
- ^ Behera, D; Balamugesh T. Lung cancer in India (PDF). Indian Journal of Chest Diseases and Allied Sciences. 2004, 46 (4): 269–281. PMID 15515828.
- ^ Charloux A, Quoix E, Wolkove N et al. The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma. International Journal of Epidemiology. 1997-02, 26 (1): 14–23. doi:10.1093/ije/26.1.14. PMID 9126499.
- ^ Kadara, H; Kabbout M; Wistuba II. Pulmonary adenocarcinoma: a renewed entity in 2011. Respirology. 2012-01, 17 (1): 50–65. doi:10.1111/j.1440-1843.2011.02095.x. PMID 22040022.
- ^ Morgagni, Giovanni Battista. De sedibus et causis morborum per anatomen indagatis. 1761. OL 24830495M.
- ^ Bayle, Gaspard-Laurent. Recherches sur la phthisie pulmonaire. Paris. 1810. OL 15355651W.
- ^ 148.0 148.1 Witschi, H. A short history of lung cancer. Toxicological Sciences. 2001-11, 64 (1): 4–6. doi:10.1093/toxsci/64.1.4. PMID 11606795.
- ^ Adler, I. Primary Malignant Growths of the Lungs and Bronchi. New York: Longmans, Green, and Company. 1912. OCLC 14783544. OL 24396062M., cited in Spiro SG, Silvestri GA. One hundred years of lung cancer. American Journal of Respiratory and Critical Care Medicine. 2005, 172 (5): 523–529. doi:10.1164/rccm.200504-531OE. PMID 15961694.
- ^ Grannis, FW. History of cigarette smoking and lung cancer. smokinglungs.com. [2007-08-06]. (原始内容存档于2007-07-18).
- ^ Proctor, R. The Nazi War on Cancer. Princeton University Press. 2000: 173–246. ISBN 0-691-00196-0.
- ^ Doll, R; Hill AB. Lung Cancer and Other Causes of Death in Relation to Smoking. British Medical Journal. 1956-11, 2 (5001): 1071–1081. doi:10.1136/bmj.2.5001.1071. PMC 2035864. PMID 13364389.
- ^ US Department of Health Education and Welfare. Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service (PDF). Washington, DC: US Government Printing Office. 1964.
- ^ 154.0 154.1 Greaves, M. Cancer: the Evolutionary Legacy. Oxford University Press. 2000: 196–197. ISBN 0-19-262835-6.
- ^ Greenberg, M; Selikoff IJ. Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879. Annals of Occupational Hygiene. 1993-02, 37 (1): 5–14. doi:10.1093/annhyg/37.1.5. PMID 8460878.
- ^ Samet, JM. Radiation and cancer risk: a continuing challenge for epidemiologists. Environmental Health. 2011-04, 10 (Suppl. 1): S4. doi:10.1186/1476-069X-10-S1-S4. PMC 3073196. PMID 21489214.
- ^ Horn, L; Johnson DH. Evarts A. Graham and the first pneumonectomy for lung cancer. Journal of Clinical Oncology. 2008-07, 26 (19): 3268–3275. doi:10.1200/JCO.2008.16.8260. PMID 18591561.
- ^ Edwards, AT. Carcinoma of the Bronchus. Thorax. 1946, 1 (1): 1–25. doi:10.1136/thx.1.1.1. PMC 1018207. PMID 20986395.
- ^ Kabela, M. Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses [Experience with radical irradiation of bronchial cancer]. Ceskoslovenská Onkológia. 1956, 3 (2): 109–115. PMID 13383622.
- ^ Saunders M, Dische S, Barrett A et al. Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. Lancet (Elsevier). 1997-07, 350 (9072): 161–165. doi:10.1016/S0140-6736(97)06305-8. PMID 9250182.
- ^ Lennox SC, Flavell G, Pollock DJ et al. Results of resection for oat-cell carcinoma of the lung. Lancet (Elsevier). 1968-11, 2 (7575): 925–927. doi:10.1016/S0140-6736(68)91163-X. PMID 4176258.
- ^ Miller, AB; Fox W; Tall R. Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus. Lancet (Elsevier). 1969-09, 2 (7619): 501–505. doi:10.1016/S0140-6736(69)90212-8. PMID 4184834.
- ^ Cohen M, Creaven PJ, Fossieck BE Jr et al. Intensive chemotherapy of small cell bronchogenic carcinoma. Cancer Treatment Reports. 1977, 61 (3): 349–354. PMID 194691.
- ^ 164.0 164.1 164.2 164.3 Brahmer, JR. Immune checkpoint blockade: the hope for immunotherapy as a treatment of lung cancer?. Seminars in oncology. 2014-02, 41 (1): 126–32. doi:10.1053/j.seminoncol.2013.12.014. PMID 24565586.
- ^ Powell, CA; Halmos, B; Nana-Sinkam, SP. Update in lung cancer and mesothelioma 2012. American Journal of Respiratory and Critical Care Medicine. 2013-07, 188 (2): 157–166. doi:10.1164/rccm.201304-0716UP. PMC 3778761. PMID 23855692.
- ^ Forde, PM; Brahmer, JR; Kelly, RJ. New strategies in lung cancer: epigenetic therapy for non-small cell lung cancer.. Clinical cancer research : an official journal of the American Association for Cancer Research. 2014-05-01, 20 (9): 2244–8. doi:10.1158/1078-0432.ccr-13-2088. PMID 24644000.
- ^ 167.0 167.1 Jamal-Hanjani, M; Hackshaw, A; Ngai, Y; et al. Tracking genomic cancer evolution for precision medicine: the lung TRACERx study.. PLOS Biology. 2014-07, 12 (7): e1001906. doi:10.1371/journal.pbio.1001906. PMID 25003521.
- ^ TRACERx project, Cancer Research UK science blog.
- ^ Spaans, JN; Goss, GD. Trials to overcome drug resistance to EGFR and ALK targeted therapies—past, present, and future. Frontiers in Oncology. 2014-08, 4 (233). doi:10.3389/fonc.2014.00233. PMC 4145253. PMID 25221748.
外部链接
| 维基共享资源中相关的多媒体资源:肺癌 |
|
||
|
_by_core_needle_biopsy.jpg)